화학1 산,염기 관련된 문제 질문드려요~
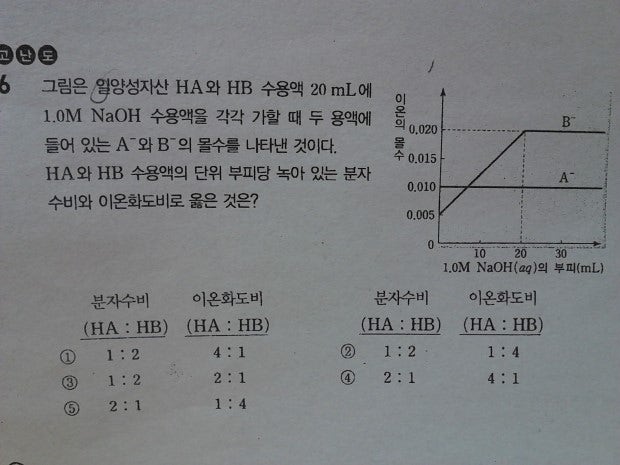


위에 문제 질문드려요~
1. B- 이온수가 NaOH의 넣어준 양과 무슨 관련이 있는거죠? 구경꾼이온은 반응에 참여 안하니까 넣어준 HB 20ml 안에 있는 B- 이온수는 변함이 없을것 같은데 증가하다가 일정하네요..
즉, 답지에선 A-이온이 강산의 짝염기이고, B-이온은 약산의 짝염기라서 위 모양의 그래프가 나왔다는데 강산 혹은 약산의 짝염기라는것과 NaOH를 넣어줌에 따라 A-, B-이온수의 변화와 무슨 관계가 있는지 궁금합니다~
2. 이온화도를 비교하는 부분에서, 이온화도= 이온화된 용질의 몰수/용질의 전체 몰수 아닌가요..?
근데 그래프 상에서 녹아있는 이온수와 전체 이온수에 대한 정보를 어디서 찾을수 있나요?;
0 XDK (+0)
유익한 글을 읽었다면 작성자에게 XDK를 선물하세요.
-
2025 의대 치대 수시 면접평가일 및 논술고사일 입시는 단연코 [Crux]...
-
이과 내신 2.1-2.2정도인데 수시 컨설팅 좋은 곳 아나요? 쪽지 보내주세요..
-
100분짜리 50에 진행하려고 하는데 후기 어떤가용 쪽지로라도 알려주세요!





















헐 이거 화학1으로 내려왔나요? ㄷㄷ
화학2 내용이었나요? ㅋㅋ;
어쩐지 어렵더라구요 ㅠㅠ
1. 네 이 부분이 밑에 말씀드린 중화적정과 더불어 가장 중요한, 심화 문제 풀이에 있어서 핵심적인 아이디어가 되는 부분입니다.
우선 B-이온은 구경꾼 이온이지만 다른 이온반응의 구경꾼 이온과 다르다는 사실을 매우 유념하여야 합니다
그 이유는 HB의 경우 '약산'입니다.
약산은 처음에 이온화가 대부분 되어있지 않습니다. 예를 들면 HB 1몰 있을때 H+ B-는 0.1몰 있다고 해보죠
여기서 H+가 들어온 OH-와 이온화가 됩니다
그러면 H+는 사라지죠 (B- 0.1몰은 그대로 있어요)
이때 다시 HB가 0.1몰 만큼 이온화가 됩니다
원래 있던 B-와, 새로 이온화된 B-가 합쳐져서 0.2몰로 양이 늘어나게 됩니다.
이런 과정이 중화점까지 쭉 이어지게 되있어요
그럼 HB가 약산인것을 어떻게 아느냐?
위의 아이디어를 이해하고 외워두면
위의 그래프처럼 B-의 이온이 증가하는 그래프를 보고 약산이라고 결론을 내릴수있어요
반드시 이해하고 암기하셔야할 사항입니다.
반면에 HA는 강산입니다
왜냐하면 만약에 약산이라면 위의 과정을 겪을테고, 아니니까 강산입니다
즉 처음부터 모든 HA가 이온화되어있습니다.
2. 말씀하신 부분 이온화도= 이온화된 용질의 몰수/용질의 전체 몰수 은 맞는내용입니다.
여기에서 이온화된 용질의 몰수와 용질의 전체 몰수는 사고를 통해서 찾아내야 합니다
처음의 이온화된 용질의 몰수가 0.010 mol / 0.005 mol 임은 바로 알수있습니다.
조금 헷갈릴수가 있어요. 막 이렇게 저렇게 복잡하게 생각할수있거든요.
아직은 중화가 전혀 되지 않은 상태이기 때문에, 위의 그래프의 몰수 (이온화된 몰수)를 통해서 비교를 할수가 있습니다.
그럼 그때 '용질의 전체 몰수'는 어떻게 알 수 있을까요?
nMV = n'M'V' 공식을 보셨을 겁니다. 그것을 사용하셔서 구하시면 됩니다
밑의 문제에서 말씀드렸듯이 약산이라고 해도 지속적으로 이온화가 일어나기 때문에
전체 몰수를 비교할때 약산/강산에 상관없이 위의 공식을 사용할수 있습니다.
그러면 B의 경우 중화점까지 넣어준 NaOH의 부피가 20mL입니다
그러므로 1 * 20 = 1 * 20 이므로 B의 농도 (이온화/이온화 안된걸 포함한 전체 용질의 농도)는 1M이 됩니다.
전체 용질의 몰수를 구해야 하므로 농도 x 부피 = 1 * 0.02 = 0.02 mol 입니다.
여기에서 A의 경우는 조금 다릅니다. 위의 그래프로는 중화점을 찾을수가 없어요
그러면 좀더 생각을 해봐야 합니다
A는 강산이므로 처음에 모든 용질이 이온화가 됩니다
그러므로 처음의 용질 몰수는 0.01 mol 입니다.
A의 이온화도 0.01/0.01 = 1 입니다 (강산이므로)
B의 이온화도 0.005/0.02 = 0.25 입니다
그러므로 이온화도의 비는 4 : 1 입니다.
이온화도 = 이온화된 용질의 몰수/ 용질의 전체 몰수 에서요~
분자의 이온화된 용질의 몰수는 맨처음 NaOH를 넣지 않은 상태에서의 몰수를 말하는 건가요?
그렇다면 이온화도를 구할때 B- 이온의 몰수가 맨 처음엔 0.005 였다가 중화점에서 0.02 이므로 0.005/0.02 이렇게 구해도 되는건가요?
네 결과적으로 보면 맞다고 해야 겠네요
B-이온이 중화점에 이르면 다 이온화가 되고,
H가 1가 산이므로 HB 한분자당 B-이온이 1개 나오므로 그렇게 구해도 됩니다.
2가 산일 경우에는 다르게 해야겠지요